Johdanto
In chemical kinetics, reaction rate constant , also known as rate constant k Or λ is a quantization representation of the chemical reaction rate.
For the Reactant A and Reactant B to be used as a chemical reaction of produce C , the reaction rate can be expressed This form:
k (t) on reaktionopeusvakio, joka muuttaa lämpötilan muutosta
[x] is assumed The volume of the substance X is in the case where the substance X is occurred in a fixed volume. (When the reaction occurs in a certain range, it can be expressed in the unit area of X.)
indeksiä m ja n kutsutaan reaktiovaiheiden lukumääräksi reaktiomekanismista riippuen. Se voidaan määrittää kokein.
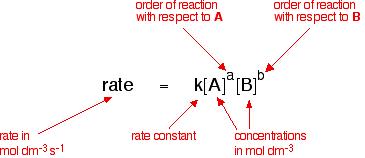
Jos reaktio voidaan kirjoittaa, se voidaan kirjoittaa myös seuraavasti:
Arnicnis-yhtälö tarjoaa kvantitatiivisen perustan reaktionopeuden ja aktivaatioenergian välisen suhteen reagoimiselle.
Kemiallinen reaktionopeus
The reaction rate is , the chemical reaction is slow, the unit is mol / (L · S) or MOL / (L · min) . The reduction in the concentration of the reactants in units of time or the amount of product concentration is increased. The concentration unit generally uses molar · sup> -1 , time units for seconds, minutes or hours. The chemical reaction is not uniformity: the reaction rate is divided into an average rate (average reaction rate at a time interval) and the instantaneous rate (the reaction rate given a given time) can be determined by experiment. The nature of the reactant itself, an external factor: temperature, concentration, pressure, catalyst, light, laser, reactant particle size, contact area and reactant state, X-ray, gamma ray, surface area of X-rays, gamma rays, solid substances, and The contact area of the reactants, the concentration of the reactants can also affect the chemical reaction rate.
törmäys
törmäysteoria, on peräisin saksalaiselta Max Trautzilta ja brittiläiseltä William Lewisilta vuosina 1916 ja 1918. Toimitetaan erikseen.
-
törmäys: Mikä tahansa kemiallinen reaktio tapahtuu, tarvittavat reaktiohiukkaset ovat lähellä törmäystä ja reaktionopeus on verrannollinen törmäysten määrään.
-
aktivointienergia: ns. aktivointienergia on pienin energia, joka voi reagoida hiukkasiin.
-
Tehokas törmäys: Ns. tehollinen törmäys tarkoittaa, että törmäyksen energia on ylittänyt aktivointienergian ja törmäyssuunnan (bitit) tulee olla oikea (kemiallisiin reaktioihin tarvittava energia).
Reaktionopeuteen vaikuttavat tekijät
Reagenssin luonteen lisäksi myös pitoisuus, lämpötila ja katalyytti ovat tärkeitä reaktionopeuteen vaikuttavia tekijöitä. Kaasureaktion nopea hitaus liittyy myös paineeseen. Lisää reagoivan aineen konsentraatiota, eli aktivoitujen molekyylien lukumäärä tilavuusyksikkönä lisääntyy, mikä lisää reagoivien molekyylien tehokkaiden törmäysten määrää yksikköaikana, mikä johtaa reaktionopeuden nopeutumiseen. Paranna reaktiolämpötilaa, eli aktivoitumismolekyylien prosenttiosuutta, lisäsi myös reagoivien molekyylien määrää aikayksiköissä, mikä johti reaktionopeuden kiihtymiseen. Positiivista katalyyttiä käyttämällä reaktioprosessia on muutettu ja reagoimiseen tarvittavaa aktivointienergiaa ja reaktionopeutta kiihdytetty. Kemiallisessa tuotannossa reaktio-olosuhteita ohjataan usein reaktionopeuden nopeuttamiseksi tuotannon lisäämiseksi. Joskus on tarpeen ryhtyä toimenpiteisiin reaktionopeuden hidastamiseksi tuotteiden käytön laajentamiseksi.
