Abriefhistoryofresearch
Inprimitivesociety,primitivepeopleperceivetheexistenceofcarbondioxideintheirdailylife,butduetothelimitationofhistoricalconditions,theylookattheinvisibleandintangiblecarbondioxide.Chengisamonsterthatkillswithoutleavingatrace,notasubstance.
3. vuosisadalla ZhangHua(232-300)Länsi-JinDynastian aikanaKiinassa on tallennettu eräänlaisena palavana valkokivenä (CaCO3)Kaasua, joka syntyi valkeatuote(CaO)valmistusprosessissa,jokahiilidioksidia käytetäänhiukkastuotteena.
Atthebeginningofthe17thcentury,theBelgiandoctorHelmont(ieJanBaptistavanHelmont,JanBaptistavanHelmont,1580-1644)discoveredthatafterburningcharcoal,inadditiontoproducingashesSomeinvisibleandintangiblesubstancesareproduced,andexperimentshaveconfirmedthatthiskindofcarbondioxide,whichhecalledthe"EssenceoftheForest",isanon-combustiblegas,andthatcarbondioxideisagas;itisalsofoundthatcandlesareinthegas.Thisisthefirstdiscoveryoftheinertnatureofcarbondioxide.Soonafter,theGermanchemistHoffmann(ieFriedrichHoffmann,1660-1742)studiedthecarbondioxidegashecalled"spiritusmineralis"andinferredforthefirsttimeThecarbondioxideaqueoussolutionisweaklyacidic.
Vuonna 1756 brittiläinen kemistiBlack(eliJosephBlack,JosephBlack,1728-1799) tutki ensimmäisenä kvantitatiivisesti "kiinteäksi ilmaksi kutsuttua hiilidioksidia". Sen jälkeen sitä kutsuttiin "kiinteäksi ilmaksi" jonkin aikaa.
In1766,BritishscientistCavendish(ieHenryCavendish,HenryCavendish,1731-1810)successfullycollectedthe"fixedair"bythemercurytankmethod,andusedphysicalmethodsThespecificgravityandsolubilityweremeasured,anditwasalsoprovedthatitisthesameasthegasexhaledbyanimalsandthegasproducedbyburningcharcoal.
Vuonna 1772 ranskalainen tiedemiesLavoisier(nimittäinAntoine-LaurentdeLavoisier,Antoine-LaurentdeLavoisier,1743-1794)etc.käyttisuuria liekkipeiliä tiivistääkseen ja lämmittääkseen elohopeaa. 1733-1804) tutkinut käymiskaasua, hän totesi, että paine on hyödyllinen "kiinteän ilman" liuottamiseen veteen, ja lämpötilan nousu ei edistä sen liukenemista. Tämän löydön ansiosta hiilidioksidia voidaan käyttää keinotekoiseen hiilihapotetun veden (soodan) valmistamiseen.
IN1774, Theswedishemistbergman (ts. Torbernolofbergman, Torbernolofbergman, 1735-1784) kuvasi "ResearchOnfixedair" "HisresearchresultsonThedsity of" ForliedAir ", liuobilitywaterinwanyairanyAirancanancuNewyAnqualyAnqualyAnqualaiLiRancyairancuNeNayAnqualyAnqualaiLiRancyairancuNeNayAnqualyAnqualaiLiRancyAnqualyairancan-ad.
Vuonna 1787 Lavoisier kuvaili"kiinteää ilmaa", joka syntyi polttamalla hiiltä ja happea, ja vahvisti, että "kiinteä ilma" koostuu hiilestä ja hapesta, koska se on kaasua ja nimettiin uudelleen "hiilidioksidiksi". hiilidioksidin sijainti ensimmäistä kertaa.
Vuonna 1797,BritishchemistTennant(eliSmithsonTennant,SmitbsonTennant,1761-1815,käännetty myös "Tainet" jne.) käytti analyyttisiä menetelmiä määrittääkseen "Fixedair" sisältää 27,65 % hiiltä ja 72,35 % happea.
Vuonna 1823 brittitieteilijä Faraday (esim. Michael Faraday, Michael Faraday, 1791-1867) havaitsi, että paineistus voi nesteyttää "hiilihappokaasua". Samana vuonna Faraday ja David(nimittäin HumphryDavy,1778-1778-1829.
Vuonna 1834 tai 1835 saksalainen tiroli (eli AdrianJean-PierreThilorier,Adrien-Jean-PierreThilorier,1790-1844 ja käännös"Tilorel","Dilauriyari","Chilorie"jne.).
Vuonna 1840 ranskalainen kemisti Dumas (eli Jean-BaptisteAndréDumas,Jean-BaptisteAndréDumas, 1800-1884) punnitsi tarkasti puhtaan hiiligrafiitin, joka on poltettu riittävästi happea, ja tuloksena on"hiilimassasta"happimassaa. 34:27.266. Aikaisemmin,Avogadro(eli AmedeoAvogadro,AmedeoAvogadro,9.8.1776- 9. heinäkuuta 1856) esittihypoteesin1811-"Samassa lämpötilassa ja alipaineessa mikä tahansa kaasusamamäärä sisältää saman määrän molekyylejä."Kemistit yhdistävät hapen ja hiilen atomipainotsaatakseen"kiinteän"ilman1,joka on "kiinteä ilma"1:n kaasunpoistoon,joka on kiinnitetty2happi- ja hiiliatomien määrään1. ir"mitattiin 44:ksi kokeilla,ja"kiinteän ilman"kemiallinen kaava oli CO2, joka on sama kuin tämä kemiallinen kaava. Vastaava nimi on "hiilidioksidi" .
Vuonna 1850 Irlannin fysikaalinen kemistiAndrews(eli,ThomasAndrews,ThomasAndrews,1813-1885) alkoi tutkiahiilidioksidin superkriittistä ilmiötä,ja vuonna 1869:ssaperustuntiva. kahdesta vuonna 2013 oli 7,375 MPa ja 303,05 kt).
In1896,theSwedishchemistArrhenius(SvanteAugustArrhenius,SvanteAugustArrhenius,1859-1927)pointedoutbycalculationthattheatmosphereAdoublingoftheconcentrationofcarbondioxidecanincreasethesurfacetemperatureby5to6°C.
Between1950and1952,theSovietUnion’sLyubavsky(KBЛюбавский),Novorzhlov(HMНовожилов)andJapan’sHarujiroSekiguchieachstudiedtheuseofaprotectivegasforcarbondioxide.Usedweldingwire,andproposedanewmetallurgicalprogramforweldingsteel.Subsequently,in1953,Ljubavskyandothersinventedcarbondioxidegasshieldedwelding.
Molekyylirakenne
CO₂molekyylirakenne | CO₂-sidosprosessi |
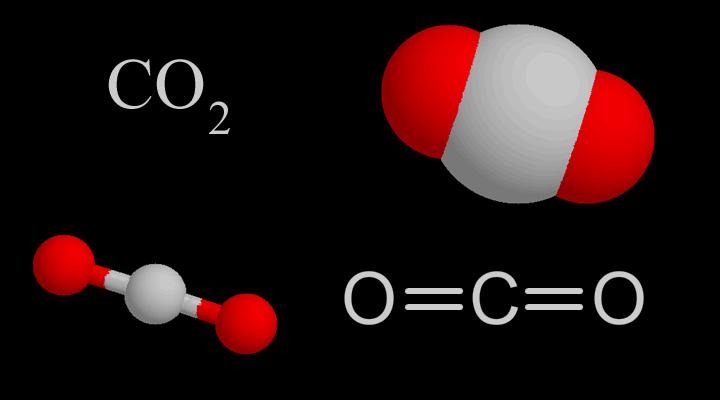
CO2Molekyylimuoto on suora, sen rakenne oli ajateltu:O=C=O. Mutta hiili-happisidoksen pituus CO2-molekyylissä on 116 pm, mikä on hiilen ja hapen välissä (sidoksen pituus on 124 pm) ja hiili-happikolmoissidos (sidoksen pituus 113 pm), joten CO2:lla on tietyn asteen kolmoissidosominaisuudet.
ModernscientistsgenerallythinkthatthecentralcarbonatomofCO2moleculeadoptssphybridization,andthetwosphybridorbitalsarerespectivelyconnectedwiththe2porbitalsoftwooxygenatoms(containingoneelectron).)Overlappingtoform2σbonds,theporbitalsperpendiculartoeachotheronthecarbonatomsandtheparallelporbitalsofthe2oxygenatomsrespectivelyform2largeπbonds.
Fysikaaliset ja kemialliset ominaisuudet
Fysikaaliset ominaisuudet
Hiilidioksidi on väritöntä ja hajutontakaasun lämpötilassa ja paineessa ja liukenee useimpiin orgaanisiin liuottimiin, kuten veteen ja hiilivetyihin. Fysikaaliset vakiot ovat seuraavat:
Sulamispiste | > 527 kPa | Celsius (°C) | > -56.6 |
Kiehumispiste | Celsius (℃) | > -78,5 | |
Suhteellinen tiheys | > -79℃,vesi=1 | 1,56 | |
Suhteellinen höyryntiheys | > Ilma=1 | 1,53 | |
Kyllästetty höyrynpaine | > -39 ℃ | > kPa(kPa) | > 1013.25 |
Kriittinen lämpötila | Celsius (°C) | > 31.3 | |
kriittinen paine | MegaPascal (MPa) | > 7,39 | |
Oktanoli/vesi-jakautumiskerroin | > 0,83 | ||
Taitekerroin | > 12,5~24 ℃ | 1,173~1,999 | |
molaaritaitekerroin | > 6,98 | ||
Viskositeetti | > 21℃,5,92 MPa | > mPa·s | > 0,0697 |
Haihtumislämpö p> | Sublimaatio | kJ/mol(kJ/mol) | > 25.25 |
Lämpöfuusio | kJ/mol(kJ/mol) | > 8.33 | |
Luo lämpöä | kJ/mol(kJ/mol) | > 394,40 | |
Erityinen lämpökapasiteetti | > 20 ℃,vakiopaine | kJ/kg·Kelvin[kJ/(kg·K)] | > 2,8448 |
höyrynpaine | > 5,9 - 14,9 ℃ | MegaPascal (MPa) | > 4.05~5.07 |
Lämmönjohtavuus | > 12~30 ℃ | W/(m·K)] | 0,10048~83,74×10-7 |
rungon laajenemiskerroin | > -50~0 ℃ | perKelvin(K-1) | > 0,00495 |
0~20 ºC | PerKelvin(K-1) | > 0,00991 | |
Moolitilavuus | Millilitrapermooli (mL/mol) | > 44.7 | |
Isometrinen ominaistilavuus | > 90,2 kt | 60,9 | |
pintajännitys | Dynesenttimetri (dyne/cm) | > 3.4 | |
Polarisaationopeus | 10-24cm3 | 2,76 | tr>
(Viite:)
Kemialliset ominaisuudet
Hiilidioksidi on yksi hiilen ja hapen yhdisteistä. Se on epäorgaaninen aine, ei palava eikä käytännöllisesti katsoen tue palamista eikä ole myrkytön alhaisilla pitoisuuksilla. hapettava ja ei-pelkistävä, mutta hapettava. Ei vahva.
1.Happooksidien yleisyys
1-1.Reagoi veden kanssa
Hiilidioksidiliukenee veteen ja reagoi veden kanssa muodostaen hiilihappoa. Epästabiili hiilihappo hajoaa helposti vedeksi ja hiilidioksidiksi. Vastaava kemiallinen reaktioyhtälö on:
;
.
1-2.Reagoi alkalioksidin kanssa
Tietyissä olosuhteissa hiilidioksidiSe voi reagoida alkalioksidien kanssa muodostaen vastaavia suoloja, kuten:
;
.
1-3.Reagoi alkalin kanssa
①jakalsiumhydroksidireaktio
Addingcarbondioxidetotheclarifiedlimewaterwillmaketheclarifiedlimewaterturbidandformcalciumcarbonateprecipitation(thisreactionOftenusedtotestcarbondioxide),thecorrespondingchemicalreactionequationis:
Kun hiilidioksidia on liikaa, muodostuu kalsiumkarbonaattia:
Ensimmäinen askel:;
Toinen vaihe:;
Yleinen yhtälö:.
Becauseofthehighsolubilityofcalciumbicarbonate,ifcarbondioxideisaddedtotheturbidlimewaterforalongtime,itcanbefoundthattheprecipitationgraduallydisappears.
②Reaktio natriumhydroksidin kanssa
Carbondioxidewilldeterioratecausticsoda.Thecorrespondingchemicalreactionequationis:
Kun hiilidioksidia on liikaa, muodostuu natriumbikarbonaattia:
Ensimmäinen vaihe:;
Toinen vaihe:;
Yleinen yhtälö:.
2.Heikosti hapettava
2-1. Hiilielementtien vähentäminen
Korkeissa lämpötiloissa hiilidioksidi voi reagoida hiilielementtien kanssa muodostaen hiilimonoksidia. Vastaava kemiallinen reaktioyhtälö on:
.
2-2.Magnesiumelementtien vähentäminen
Valaistusolosuhteissa magnesiumbaaritSe voi polttaa hiilidioksidia ja vastaava kemiallinen reaktioyhtälö on:
.
2-3.Vedytyksen vähentäminen
Hiilidioksidi ja vety aiheuttavat sarjan reaktioita metanolin, hiilimonoksidin ja metaanin tuottamiseksi. Useiden reaktioiden kemialliset reaktioyhtälöt ovat:
;
osio>;
.
2-4.Sähkökemiallinen pelkistys
>> Jännitteen muoto,joka estää hiilidioksidin pienenemisen. Sen vuoksi hiilidioksidin tehokas vähentäminen vaatii sopivan katalyytin, jotta hiilidioksidin sähkökemiallinen pelkistyspehmentäisi sähkökatalyyttiä vähentämisprosessia. ①);elektrodeja siirretään kahden elektrodin välisen mahdollisen eron seurauksena, ja siirtojen määrä voi olla 2, 4, 6, 8 ,12.Pelkistystuote voi olla hiilimonoksidia, formiaattia, muurahaishappoa, jne.Fekroniirtojen lukumäärästä riippuen (reaktiokaava②-④).⑵Anodeofeleelektrolyysikenno: Vedynkehitysreaktio tapahtuu vesiliuoksessa vedyn tuottamiseksi (reaktio,⥹muodossa).Kalsinointimenetelmä
Kermentointikaasun talteenottomenetelmä
Sivutuotteiden kaasun talteenottomenetelmä
Adsorptionlaajennusmenetelmä
CharcoalKilnMethod
Valmistus marmorin ja laimean kloorivetyhapon reaktiolla
Lämpöhajoaa natriumbikarbonaatti valmistellakseen
Ympäristövaarat
Vastatoimenpiteet
①
②
③
④
⑤
⑥
3.Reagoi peroksidin kanssa
Hiilidioksidi voi reagoida natriumperoksidin (Na2O2) kanssa muodostaen natriumkarbonaattia (Na2CO3) ja happea (O
4.Reagoi Grignardreagenssilla
Underacidicconditions,carbondioxidecanreactwithGrignardreagentinanhydrousethertoformcarboxylicacid,thecorrespondingchemistryThereactionequationis:
Kuvaus: Intheformula,Risanalifaattinen hiilivetyryhmäporanaromaattinen hiilivetyryhmä ja Xisahalogeeni.
5.Interkalaatioreaktio epoksiyhdisteiden kanssa
Carbondioxidecanreactwithepoxycompoundstoformcycliccarbonatesundertheactionofelectrocatalysis,correspondinglyThechemicalreactionequationis:
6.Timantin valmistelu (korvausreaktio)
440 ℃ (713,15 K) ja 800 ilmakehän (noin 808 MPa) lämpötilassa hiilidioksidi voi reagoida natriummetallin kanssa tuottaen timanttia, ja vastaava kemiallinen reaktioyhtälö on:.
7. Fotosynteesin pimeä vaikutus
Carbondioxideparticipatesinthedarkreactionofphotosynthesisandisanindispensablerawmaterialforphotosynthesisofgreenplants.Theprocessiscalled"carbondioxidefixation",andthecorrespondingchemicalreactionequationis:
Selitys: C5kaavassa1,5-Ribuloosidifosfaatti, 2C3on 2 molekyyliä 3-fosfoglyseraattia.
Waysofproduction
Carbondioxideisapartoftheatmosphere(0.03%-0.04%ofthetotalvolumeoftheatmosphere).Itisabundantinnature.Themainwaysofproductionareasfollows:①Organicmatter(includinganimalsandplants)canreleasecarbondioxideintheprocessofdecomposition,fermentation,decayanddeterioration.②Duringthecombustionofpetroleum,paraffin,coal,andnaturalgas,carbondioxideisalsoreleased.③Petroleumandcoalalsoreleasecarbondioxideduringtheproductionofchemicalproducts.④Allfecesandhumicacidcanalsoreleasecarbondioxideduringfermentationandmaturation.⑤Allanimalsmustbreatheinoxygenandexhalecarbondioxide.
Valmistusmenetelmä
Teollinen valmistus
Kalkkikiven (ordolomiitin) korkean lämpötilan kalsinointiprosessissa tuotettu hiilidioksidikaasu pestään, poistetaan epäpuhtaudet ja puristetaan hiilidioksidikaasun tuottamiseksi:
.
Vesipesu, epäpuhtauksien poisto, puristus, hiilidioksidikaasun saanti.
Ammonia,hydrogen,andsyntheticammoniaareoftenproducedintheproductionprocessTheprocessofdecarburization(removalofcarbondioxideinthegasmixture)allowsthecarbondioxideinthemixedgastobeabsorbedunderpressureandheatedunderreducedpressuretoobtainhigh-puritycarbondioxidegas.
Yleensä sivutuotehiilidioksidia käytetäänraaka-aineenakaasuna, jaadsorptiolaajennusta käytetään.Menetelmäpoistaa erittäin puhdasta hiilidioksidia pääsorptiovaiheesta ja kerää tuotteenakryogeenisellä pumpulla; voidaan valmistaa korjauksen jälkeen. Erittäin puhtaat hiilidioksidituotteet.
Se on puhdistettu hiilenuunikaasusta saadusta kaasustajametanolikrakkauksestaHanki hiilidioksidia.
Laboratoriovalmistus
Kaava
Thelaboratoryproducescarbondioxide,marbleanddilutehydrochloricacid.Bothtypesofsodaarenotused,andthespeedistoofasttocontrol.
Withoutsulphuricacidhydrochloricacid,magnesiumsaltisnotascheapascalciumsalt.Nitricacidiseasytodecomposewhenexposedtolight.
Reaktiotuotteet
Marmori- tai kalkkikivi (pääkomponentti onCaCO3) ja laimea kloorivetyhappo. (Hiilidioksidin, marmorin ja laimean kloorivetyhapon laboratoriotuotanto)
Reaktioperiaate
Reaktioyhtälö:
Valmistuslaite
Kiinteä-nestenormaalilämpötilatyyppi (kuvassa).
Keräysmenetelmä
Becausecarbondioxidehasahigherdensitythanair,itissolubleinwaterandcanreactwithwater,theupwardairexhaustmethodisadopted.
Tarkastusmenetelmä
Pourthegeneratedgasintoclarifiedlimewater.Thelimewaterbecomesturbid,whichprovesthatthegasiscarbondioxide.
Täydellinen tarkastusmenetelmä
Theburningwoodstickisusedatthemouthofthegascylinder(cannotbeinsertedintothebottle).Iftheflamegoesout,itisprovedSetfull.
Varotoimenpiteet
①Reaktion aikana haihtuva vetykloridi(HCl)kaasu voi kulkea kylläisen natriumbikarbonaatin (NaHCO3) läpi.Liuos poistaa kloorivetykaasun syntyneestä kaasusta.
②Ifnecessary,agasscrubberfilledwithconcentratedsulfuricacidcanbeusedtoremovewatervaporinthegeneratedgas.
③Cannotreactwithcalciumcarbonateandconcentratedhydrochloricacid.Reason:Concentratedhydrochloricacidiseasytovolatilizealargeamountofhydrogenchloridegas,sothatsodiumbicarbonatecannotbecompletelyremoved,andthepurityofthecarbondioxideproducedwilldecrease.
④Laboratoriossa marmori(CaCO3) saatetaan reagoimaan laimean kloorivetyhapon kanssa hiilidioksidin tuottamiseksi.
⑤Ei voi käyttääNa2CO3(soodaa) ja NaHCO3(leivinsoodaa)CaCO3:n sijastaSe reagoi kloorivetyhapon kanssa tuottaen hiilidioksidia. Syy :Na2CO3ja NaHCO3reagoivat liian nopeasti suolahapon kanssa, syntyvä hiilidioksidi vapautuu nopeasti, mikä ei ole helppoa hallita ja toimia.
⑥Laimeaa rikkihappoa ei voida käyttää suolahapon sijasta. Syy:laimean rikkihapon ja marmorin (CaCO3) reaktio tuottaa mikro. icacid)
⑦Ei voida käyttääMgCO3(magnesiumsuola)CaCO3(kalsiumsuola) sijaan.Syy:Vaikka MgCO3reagoi samalla tavalla kloorivetyhapon jaCaCO3kanssa, koska MgCO3saa vähemmän lähteitä, ei ole hyvääCaCO3halpaa.
⑧Typpihappoa ei voida käyttää suolahapon sijasta.Syy:typpihappohajoaa helposti valolle altistuessaan().Jos kloorivetyhapon sijasta käytetään typpihappoa,saatuu CO. kloorivetyhapon sijasta. (Typpihappotauti, joka hajoaa valolle altistuessaan)
⑨Becausecarbondioxidecanextinguishthefire,aburningmatchcanbeplacedatthemouthofthegascylinderforinspection.Iftheflamegoesout,itprovesthatthegascylinderhasbeenfilledwithcarbondioxide.(Identifythatmatchesarenotcombustible)
Kun natriumbikarbonaatti on täysin kuivattu, se laitetaan kovaan lasiputkeen ja putken suu on täytetty lasivillalla, sen jälkeen tiivistetään ja vedetään tyhjiössä ilmapumpulla. Sitten lämmitys hajoaakondiiriumveteen,jossakondiioitunatriumbikarbonaatiksi. sitten kaasu johdetaan U-muotoisiin kalsiumkloridia ja fosforipentoksidia sisältäviin putkiin kuivumaan. 100 °C:ssa natriumbikarbonaatin hajoamispaine on 97,458 kPa ja 120 °Citis166,652 kPa.
Muut valmistusmenetelmät
Kun leivinsoodaa (pääkomponenttinatriumbikarbonaattia) ja valkoviinietikkaa sekoitetaan keskenään, tapahtuu ameteesireaktio ja vapautuu hiilidioksidikaasua. Vastaava kemiallinen reaktioyhtälö on: High-puritycarbondioxideismainlyusedintheelectronicsindustry,medicalresearchandclinicaldiagnosis,carbondioxidelasers,calibrationgasfortestinginstrumentsandthepreparationofotherspecialmixedgas.Itisusedasaregulatorinthepolymerizationreaction. Solidcarbondioxideiswidelyusedinrefrigerateddairyproducts,meat,frozenfoodandotherfoodsthatareperishableintransit.Itisusedasarefrigerantinmanyindustrialprocesses,suchascrushingheat-sensitivematerials,rubberpolishing,andmetalColdprocessing,shrinkassemblyofmechanicalparts,vacuumcoldtraps,etc. Gaseouscarbondioxideisusedforcarbonizationofsoftdrinks,pHcontrolinwatertreatmentprocesses,chemicalprocessing,foodpreservation,inertprotectioninchemistryandfoodprocessing,weldinggas,plantgrowthstimulant,andhardeningincastingMoldsandcoresandusedinpneumaticdevices,andalsousedasadiluentforsterilizinggas(thatis,usingamixtureofethyleneoxideandcarbondioxideasasterilization,insecticide,andfumigant.Itiswidelyusedinmedicalappliances,packagingmaterials,andclothing,Fur,bedding,etc.,sterilizationofbonemeal,fumigationofwarehouses,factories,culturalrelics,books). Liquidcarbondioxideisusedasarefrigerant,low-temperaturetestsofaircraft,missilesandelectroniccomponents,toimproveoilwellrecovery,rubberpolishingandchemicalreactioncontrol,andcanalsobeusedasafireextinguishingagent. Ylikriittistä hiilidioksidia voidaan käyttää liuottimena polaarittomien, ei-ionisten ja pienimolekyylisten yhdisteiden liuottamiseen, joita käytetään laajalti homogeenisissa reaktioissa. Hydrofobisen parametrin (XlogP) laskennan vertailuarvo 0.9 Vetysidosvastaanottimien lukumäärä 2 Topologinen molekyylien polaarinen pinta-ala 34.1 Raskaiden atomien määrä 3 Monimutkaisuus 18.3 Kovalenttien sidosyksiköiden lukumäärä 1 (Taulukkoviittaus:) Luonnollinen kasvihuoneilmiö:ilmakehän kasvihuonekaasut, kuten hiilidioksidi, voivat absorboida voimakkaasti maasta tulevaa pitkäaaltosäteilyä.Pitkäaaltoinen säteily, jonka aallonpituus on pidempi, säteilee maahan, joka on eristävä maata. Enhancedgreenhouseeffect:SincetheIndustrialRevolution,humanactivitieshaveemittedalargeamountofgreenhousegasessuchascarbondioxide,whichhascausedtheconcentrationofgreenhousegasesintheatmospheretorisesharply,resultinginanincreasinggreenhouseeffect.Accordingtostatistics,beforeindustrialization,theglobalaverageannualatmosphericcarbondioxideconcentrationwas278ppm(1ppmisonepartpermillion).In2012,theglobalaverageannualatmosphericcarbondioxideconcentrationwas393.1ppm.ByApril2014,themonthlyaveragecarbondioxideconcentrationintheatmosphereofthenorthernhemisphereItexceeded400ppmforthefirsttime. Globalwarming:Theincreasinggreenhouseeffectoftheatmospherehasledtoglobalwarming,resultinginaseriesofglobalclimateproblemsthatareunpredictablebysciencetoday.AccordingtotheInternationalEconomicsofClimateChangeReport,ifhumanbeingscontinuetomaintaintheircurrentlifestyles,by2100,thereisa50%chancethattheglobalaveragetemperaturewillriseby4°C.Iftheglobaltemperaturerisesby4℃,theglaciersinthenorthandsouthpolesoftheearthwillmelt,andthesealevelwillriseasaresult.Morethan40islandcountriesandthemostpopulouscoastalcitiesintheworldwillbeindangerofbeingsubmerged,withtensofmillionsofpeopleworldwide.Hislifewillfaceacrisis,andevenaglobalecologicalbalancedisorderwilleventuallyleadtolarge-scalemigrationandconflictsaroundtheworld. Matalahiilinen: Minimoi päivittäisen elämän energiankulutus, mikä vähentää hiilidioksidipäästöjä, vähentää saastumista ja hidastaa ekologista hajoamista. CCStechnology:carbondioxidecaptureandstorage(CarbonDioxideCaptureandStorage,abbreviation:CCS)technology,isoneofthemostimportanttechnologiestodealwithglobalclimatechangeintheshortterm,referringtotheuseofcarboncapturetechnology,Separatethecarbondioxideproducedbyindustryandrelatedenergyindustries,andthentransportandsealittotheseabedorunderground,etc.,whichisisolatedfromtheatmosphere,throughstoragemeans. Internationallaw:AttheUnitedNationsConferenceonEnvironmentandDevelopmentheldinBrazilinJune1992,153countriessignedtheUnitedNationsFrameworkConventiononClimateChange.ThisconventionhasbeeneffectivesinceMarch1994.Thereare176contractingparties(asofFebruary2015);InDecember1997,ameetingattendedbyparticipatingcountriesofthe"JointFrameworkConventiononClimateChange"washeldinKyoto,Japan.Themeetingformulatedthe"KyotoProtocol"asthe"JointFrameworkConventiononClimateChange".AsupplementaryclausetotheFrameworkConventiononChange.ThistreatyhasbeeneffectivesinceFebruary16,2005,andhas183contractingparties(asofFebruary2009);November30-December11,2015,heldinParisAtthe21stConferenceofthePartiestothe"JointFrameworkConventiononClimateChange"andthe11thConferenceofthePartiestothe"KyotoProtocol",representativesfrom195countriesunanimouslyadoptedthe"ParisAgreementoftheUnitedNationsFrameworkConventiononClimateChange"("ParisAgreement"). Researchshowsthatwhentheconcentrationofcarbondioxideintheairislessthan2%,thereisnoobviousharmtohumans.Iftheconcentrationexceedsthisconcentration,itcancausedamagetothehumanrespiratoryorgans.Undercircumstances,carbondioxideisnotatoxicsubstance,butwhentheconcentrationofcarbondioxideintheairexceedsacertainlimit,thebodywillbepoisoned,andhighconcentrationsofcarbondioxidewillsuffocatepeople.Animalexperimentshaveprovedthat:intheairwithnormaloxygencontent(20%),thehighertheconcentrationofcarbondioxide,thehigherthemortalityofanimals.Atthesametime,purecarbondioxidecausesanimaldeathsanddeathscausedbyloweroxygenaremorerapid.Inaddition,somepeoplebelievethatinthecaseoflowoxygen,carbondioxideataconcentrationof8%to10%cancausedeathsofhumansandanimalsinashortperiodoftime. Myrkytyksen periaate High-concentrationcarbondioxideitselfhasstimulatingandanestheticeffectsandcancausehypoxiaandasphyxiationinthebody. Myrkytyksen oireet Lievä: yleinen epämukavuus, huimaus, päänsärky, lihasheikkous ja kehon kivut. Keskivaikea:huimaus saattaa pudota maahan;rintakipu, sietämätön kipu nenäontelossa ja kurkussa, hengenahdistus, paineet ja tukehtuminen rinnassa;vakava päänsärky, tinnitus, lihasheikkous, ihon punoitus, verenpaineen nousu ja voimakas pulssi. Vakava:Yhtäkkiä pyörryttää eikä pysty tukemaan,putoaminen maahan,hengityksen pidättäminen, hengenahdistus, sydämentykytys, tajuttomuus, kooma, mustelmat, huulet ja kynnet, verenpaineen lasku, heikko pulssi ja laajentuneet pupillit. akuutin jakson jälkeen hargyja muistin menetys. Ensimmäiset toimenpiteet ①Quicklygetthepoisonedpersonoutofthehigh-concentrationcarbondioxideenvironment,gotothefreshair,loosenthepoisonedperson’scollar,artificialassistanceBreatheinordertobreatheinoxygenassoonaspossible,andtreatwithhyperbaricoxygenifnecessary.Rescuersshouldweareffectiverespiratoryprotectiveequipment. ②Injectrespiratorystimulants,andantibioticsforsecondaryinfections;intravenousinfusionofsodiumbicarbonateorsodiumlactateforreducedcarbondioxidebindingcapacity;largerdosesofsedativesforlimbspasm;long-termhighfeverandconvulsionsSedativedrugscanbeused;othersymptomatictreatmentssuchaspulmonaryedemaandcerebraledema. Varotoimenpiteet Beforeenteringaworkareawithahigherconcentrationofcarbondioxide,checkwhethertheconcentrationofcarbondioxideintheairexceeds2%.Ifitexceeds,youneedtoTakeeffectivesafetymeasures,suchas:①Ventilationanddetoxification,replacingtheairintheworkplace,sothattheconcentrationofcarbondioxideintheairdoesnotexceed2%;②Wearingventilationmasks,self-primingductgasmasks,oxygenbreathingapparatusandothercommonlyusedanti-virusmask. Carbondioxideissuitableforstorageinacool,ventilatednon-combustiblegaswarehouse,suitableforshipmentinliquidorsolidform.Payattentiontothefollowingpointswhenstoringandtransportingcarbondioxide:①Keepawayfromfireandheatsources,andthestoragetemperatureshouldnotexceed30℃;②Storeseparatelyfromeasily(combustible)materialsandavoidmixedstorage;③Thestorageareashouldbeequippedwithleakageemergencytreatmentequipment. Kiinassa hiilidioksidijulkaistiin 12. huhtikuuta 2007 ja otettiin käyttöön 1. marraskuuta 2007. Osa 1: Ammattialtistusrajat vaarallisten tekijöiden osalta. (PC-TWA)työpaikalla on9000mg/m3,Permissible Concentration-ShortTermExposureLimit(PC-STEL)on18000mg/m3.Lisäksikansallinen säädös, joka liittyy läheisesti hiilidioksidiin, onkansallinen standardi"Methodforthedeterminationofcarbonoxidesform4contentho2conten0/T12-0GB4. standardi on hyväksytty syyskuussa 2014. Korvattu "Julkisen paikan hygieniatarkastusmenetelmätOsalla 2 :ChemicalPollutants"(GB/T18204.2-2014)julkaistu 3.12.2014ja otettu käyttöön 1.12.2014.Hiilidioksidin havaitsemiseksi,"JulkinenPlaceSanitationDetectionm"suosittelemastandardintestausmenetelmät( pitoisuus on 0,01 %),ja kaasukromatografiamenetelmä (pienin havaittava pitoisuus on 0,014 %), tilavuustitrausmenetelmä ( pienin havaittava pitoisuus on 0,001 %). YhdysvalloissaAmericanConferenceOFGovernmentalIndustrialHygienists(ACGIH)kynnyskeskittymä,TyöturvallisuusjaTerveyshallinto(OccupationalSafetyandHealthAdministration,OSHA)sallittu 0 -6).Mainapplications
Kemiallisten tietojen laskenta
Turvatoimenpiteet
Luonnolliset ympäristönäkökohdat
Intermsofhumanhealth
Storageprecautions
Relevantit lait ja määräykset
