Abriefhistoryofresearch
Inprimitivesociety,primitivepeopleperceivetheexistenceofcarbondioxideintheirdailylife,butduetothelimitationofhistoricalconditions,theylookattheinvisibleandintangiblecarbondioxide.Chengisamonsterthatkillswithoutleavingatrace,notasubstance.
Ve 3. století zaznamenal ZhangHua (232-300) během dynastie Western Jin v Číně druh spalování bílého kamene (CaCO3)Plynu, který se vyrábí v procesu výroby bílého popílku (CaO), což je sněhová pec na výrobu oxidu uhličitého v průmyslu.
Atthebeginningofthe17thcentury,theBelgiandoctorHelmont(ieJanBaptistavanHelmont,JanBaptistavanHelmont,1580-1644)discoveredthatafterburningcharcoal,inadditiontoproducingashesSomeinvisibleandintangiblesubstancesareproduced,andexperimentshaveconfirmedthatthiskindofcarbondioxide,whichhecalledthe"EssenceoftheForest",isanon-combustiblegas,andthatcarbondioxideisagas;itisalsofoundthatcandlesareinthegas.Thisisthefirstdiscoveryoftheinertnatureofcarbondioxide.Soonafter,theGermanchemistHoffmann(ieFriedrichHoffmann,1660-1742)studiedthecarbondioxidegashecalled"spiritusmineralis"andinferredforthefirsttimeThecarbondioxideaqueoussolutionisweaklyacidic.
V roce 1756 byl Britský chemik Black (tj. JosephBlack, Joseph Black, 1728-1799) prvním, kdo kvantitativně studoval oxid uhličitý, který se nazýval „pevný vzduch“. Poté byl po určitou dobu nazýván „pevný vzduch“.
In1766,BritishscientistCavendish(ieHenryCavendish,HenryCavendish,1731-1810)successfullycollectedthe"fixedair"bythemercurytankmethod,andusedphysicalmethodsThespecificgravityandsolubilityweremeasured,anditwasalsoprovedthatitisthesameasthegasexhaledbyanimalsandthegasproducedbyburningcharcoal.
V roce 1772,Jph,Jph,3,francouzský vědec Lavoisier (jmenovitě Antoine-LaurentdeLavoisier,Antoine-LaurentdeLavoisier,1743-1794)atd.použil 3největší zrcadlo plamene ke kondenzaci a zahřívání rtuti. 1804) studoval fermentovaný plyn, zjistil, že tlak je prospěšný pro rozpouštění „pevného vzduchu“ ve vodě, a zvýšení teploty nevede k jeho rozpuštění..Tento objev umožňuje použít oxid uhličitý k umělé výrobě sycené vody (sody).
V roce 1774 popsal švédský chemik Bergman (tj. TorbernOlofBergman,TorbernOlofBergman,1735-1784)ve svém papíru"Výzkum na pevnémvzduchu"jehovýsledkyvýzkumuexistencehustoty"pevnéhovzduchu",rozpustnosti,rozpustnosti,rozpustnosti ve vodě,rozpustnosti ve vodě,roztokem.
V roce 1787 Lavoisier popsal "pevný vzduch" vyrobený spalováním uhlíku a kyslíku, přičemž potvrdil, že "pevný vzduch" je složen z uhlíku a kyslíku, protože je to plyn a byl přejmenován na "oxid uhličitý, 3% pro uhlík". oxidem poprvé.
V roce 1797 použil britský chemik Tennnant (tj. SmithsonTennant,SmitbsonTennant,1761-1815, také v překladu „Tainet“ atd.) analytickou metodu k určení, že „Pevný vzduch“ obsahuje 27,65 % uhlíku a 72,35 % kyslíku.
V roce 1823 objevil britský vědec Faraday (tj. Michael Faraday, Michael Faraday, 1791-1867), že přetlakování může zkapalnit „uhličitý plyn“.
V roce 1834 nebo 1835 německý tyrolský (tj. AdrianJean-PierreThilorier, Adrien-Jean-PierreThilorier,1790-1844 a přeloženo "Tilorel","Dilauriyari","Chilorie"atd. úspěšně vyráběl suchý oxid (pevný uhličitý).
V roce 1840 francouzský chemik Dumas (jmenovitě Jean-BaptisteAndréDumas,Jean-BaptisteAndréDumas,1800-1884)vložil přesně zvážený obsah, aby čistý karbongrafit spaloval nedostatečným množstvím kyslíku, a výsledkem je, že "pevný vzduch" nasycený vzduchem "opravený" 7% je absorbován kyslíkem, 7 je absorbován kyslíkem. .Earlier,Avogadro(tj.AmedeoAvogadro,AmedeoAvogadro,August9,1776- 9. července 1856)předložil hypotézu v roce 1811-"Při stejné teplotě a podtlaku každý plyn ze stejného objemu obsahuje stejný počet molekul." Chemici kombinují tepelné atomické hmotnosti kyslíku. vzduch" byl pomocí experimentů naměřen na 44 a chemický vzorec "pevného vzduchu" byl CO2, který je stejný jako tento chemický vzorec. Odpovídající název je "oxid uhličitý" .
V roce 1850 začal irský fyzikální chemik Andrews (tj. Thomas Andrews, Thomas Andrews, 1813-1885) studovat superkritický fenomén oxidu uhličitého a v roce 1869 změřil 5 MPa kritického tlaku a 7 kritických parametrů. v roce 2013 to bylo 7,375 MPa a 303,05 K).
In1896,theSwedishchemistArrhenius(SvanteAugustArrhenius,SvanteAugustArrhenius,1859-1927)pointedoutbycalculationthattheatmosphereAdoublingoftheconcentrationofcarbondioxidecanincreasethesurfacetemperatureby5to6°C.
Between1950and1952,theSovietUnion’sLyubavsky(KBЛюбавский),Novorzhlov(HMНовожилов)andJapan’sHarujiroSekiguchieachstudiedtheuseofaprotectivegasforcarbondioxide.Usedweldingwire,andproposedanewmetallurgicalprogramforweldingsteel.Subsequently,in1953,Ljubavskyandothersinventedcarbondioxidegasshieldedwelding.
Molekulární struktura
Molekulární struktura CO₂ | Proces vázání CO₂ |
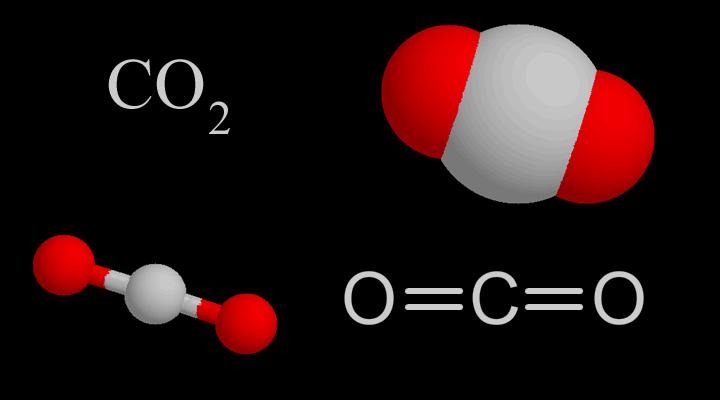
CO2Tvar molekuly je rovný, jeho struktura byla považována za: O=C=O. Ale délka vazby uhlík-kyslík v molekule CO2je 116 pm, což je mezi dvojitou vazbou uhlík-kyslík (délka vazby je 124 pm) a trojitá vazba uhlík-kyslík (délka vazby je 113 pm), takže CO2 má určitý stupeň charakteristik trojné vazby.
ModernscientistsgenerallythinkthatthecentralcarbonatomofCO2moleculeadoptssphybridization,andthetwosphybridorbitalsarerespectivelyconnectedwiththe2porbitalsoftwooxygenatoms(containingoneelectron).)Overlappingtoform2σbonds,theporbitalsperpendiculartoeachotheronthecarbonatomsandtheparallelporbitalsofthe2oxygenatomsrespectivelyform2largeπbonds.
Fyzikální a chemické vlastnosti
Fyzikální vlastnosti
Oxid uhličitý je při pokojové teplotě a tlaku plynu bezbarvý a bez zápachu a je rozpustný ve většině organických rozpouštědel, jako je voda a uhlovodíky. Fyzikální konstanty jsou následující:
Vlastnosti
Podmínky nebo symboly
Jednotka
Data
tr>Bod tání | > 527 kPa | Celsius (°C) | -56,6 |
Bod varu | Celsius (℃) | -78,5 | |
Relativní hustota | -79℃,voda=1 | 1,56 | |
Relativní hustota páry | Vzduch=1 | 1,53 | |
Tlak nasycené páry | -39℃ | > kPa(kPa) | 1013,25 |
Kritická teplota | Celsius (°C) | 31.3 | |
kritický tlak | MegaPascal (MPa) | 7.39 | |
Rozdělovací koeficient oktanol/voda | 0,83 | ||
Index lomu | 12,5~24℃ | 1,173~1,999 | |
molární index lomu | 6,98 | ||
Viskozita | 21℃,5,92 MPa | mPa·s | 0,0697 |
Vypařovací teplo p> | Sublimace | kJ/mol(kJ/mol) | 25.25 |
Tepelná fúze | kJ/mol(kJ/mol) | 8.33 | |
Vygenerovat teplo | kJ/mol(kJ/mol) | 394,40 | |
Specifická tepelná kapacita | 20 ℃, konstantní tlak | kJ/kg·Kelvin[kJ/(kg·K)] | 2,8448 |
Tlak páry | 5,9–14,9℃ | MegaPascal (MPa) | 4.05–5.07 |
Tepelná vodivost | 12~30℃ | Wattspermetr Kelvin[W/(m·K)] | 0,10048~83,74×10-7 |
koeficient roztažení těla | -50~0℃ | perKelvin(K-1) | 0,00495 |
0~20ºC | PerKelvin(K-1) | 0,00991 | |
Molevolum | mililitrpermol (ml/mol) | 44.7 | |
Izometrický specifický objem | > 90,2 kB | 60,9 | |
povrchové napětí | Dynepercentimetr (dyne/cm) | 3.4 | |
Rychlost polarizace | 10-24cm3 | 2,76 |
(Odkaz:)
Chemické vlastnosti
Oxid uhličitý jako jeden ze sloučenin uhlíku a kyslíku.Je to anorganická látka, nehořlavá a obvykle nepodporuje hoření a není toxický při nízkých koncentracích.Je to také kyselý hydrid kyseliny uhličité. oxidační a nereduktivní, butoxidující. Nesilný.
1. Všeobecnost oxidů kyselin
1-1. Reagujte s vodou
Oxid uhličitý se může rozpouštět ve vodě a reagovat s vodou za vzniku kyseliny uhličité. Nestabilní kyselina uhličitá se snadno rozkládá na vodu a oxid uhličitý. Odpovídající chemická reakční rovnice je:
;
.
1-2. Reagovat s alkalickým oxidem
Za určitých podmínek může oxid uhličitý reagovat s oxidem alkalickým za vzniku odpovídajících solí, jako jsou:
;
.
1-3. Reactwithalkali
①aHydroxid vápenatýReakce
Addingcarbondioxidetotheclarifiedlimewaterwillmaketheclarifiedlimewaterturbidandformcalciumcarbonateprecipitation(thisreactionOftenusedtotestcarbondioxide),thecorrespondingchemicalreactionequationis:
Když je oxid uhličitý nadměrný, tvoří se hydrogenuhličitan vápenatý:
První krok:;
Druhý krok:;
Všeobecná rovnice:.
Becauseofthehighsolubilityofcalciumbicarbonate,ifcarbondioxideisaddedtotheturbidlimewaterforalongtime,itcanbefoundthattheprecipitationgraduallydisappears.
②Reakce s hydroxidem sodným
Carbondioxidewilldeterioratecausticsoda.Thecorrespondingchemicalreactionequationis:
Když je oxid uhličitý nadměrný, tvoří se hydrogenuhličitan sodný:
První krok:;
Druhý krok:;
Všeobecná rovnice:.
2. Slabě oxidující
2-1. Redukce uhlíkových prvků
Za podmínek vysokých teplot může oxid uhličitý reagovat s prvky uhlíku za vzniku oxidu uhelnatého. Odpovídající chemická reakční rovnice je:
.
2-2.Snížení prvků hořčíku
Za světelných podmínek mohou hořčíkové tyče spalovat oxid uhličitý a odpovídající chemická reakční rovnice je:
.
2-3.Snížení hydrogenace
Oxid uhličitý a vodík dojde k řadě reakcí za vzniku methanolu, oxidu uhelnatého a metanu. Chemické reakční rovnice několika reakcí jsou:
;
sekce>;.
2-4. Elektrochemická redukce
Elektrochemická redukce oxidu uhličitého je Elektrická energie redukuje oxid uhličitý na katodě elektrolytického článku a oxiduje hydroxidové ionty na kyslík na anodě elektrolytického článku. který bude inhibovat redukci oxidu uhličitého. Efektivní redukce oxidu uhličitého proto vyžaduje vhodný katalyzátor, aby elektrochemická redukce oxidu uhličitého změkčila proces elektrokatalytické redukce. jsou přenášeny působením potenciálního rozdílu mezi dvěma elektrodami a počet přenosů může být 2, 4, 6, 8 ,12.Redukčním produktem může být oxid uhelnatý, mravenčan, kyselina mravenčí atd. v závislosti na počtu přenosů elektronů (reakční vzorec②-④).⑵Anoda elektrolyzéru:reakce vývoje vodíku probíhá ve vodném roztoku za vzniku vodíku (reakce,⑥a).
①
②
③
④
⑤
⑥
3. Reagujte s peroxidem
Oxid uhličitý může reagovat s peroxidem sodným (Na2O2) za vzniku uhličitanu sodného (Na2CO3) a kyslíku (O2),odpovídající chemická reakční rovnice je:.
4. Reagujte s Grignardreagentem
Underacidicconditions,carbondioxidecanreactwithGrignardreagentinanhydrousethertoformcarboxylicacid,thecorrespondingchemistryThereactionequationis:
Popis:Ve vzorci Risanalifatická uhlovodíková skupina nebo aromatická uhlovodíková skupina a Xisahalogen.
5. Interkalační reakce s epoxidovými sloučeninami
Carbondioxidecanreactwithepoxycompoundstoformcycliccarbonatesundertheactionofelectrocatalysis,correspondinglyThechemicalreactionequationis:
6.Příprava diamantu (náhradní reakce)
Při 440 ℃ (713,15 K) a 800 atmosférách (přibližně 808 MPa) za podmínek může oxid uhličitý reagovat s kovem sodíku za vzniku diamantu a odpovídající chemická reakční rovnice je:.
7.Temná reakce fotosyntézy
Carbondioxideparticipatesinthedarkreactionofphotosynthesisandisanindispensablerawmaterialforphotosynthesisofgreenplants.Theprocessiscalled"carbondioxidefixation",andthecorrespondingchemicalreactionequationis:
Vysvětlení: C5ve vzorci je 1,5-Ribulosedifosfát, 2C3jsou 2 molekuly 3-fosfoglycerátu.
Waysofproduction
Carbondioxideisapartoftheatmosphere(0.03%-0.04%ofthetotalvolumeoftheatmosphere).Itisabundantinnature.Themainwaysofproductionareasfollows:①Organicmatter(includinganimalsandplants)canreleasecarbondioxideintheprocessofdecomposition,fermentation,decayanddeterioration.②Duringthecombustionofpetroleum,paraffin,coal,andnaturalgas,carbondioxideisalsoreleased.③Petroleumandcoalalsoreleasecarbondioxideduringtheproductionofchemicalproducts.④Allfecesandhumicacidcanalsoreleasecarbondioxideduringfermentationandmaturation.⑤Allanimalsmustbreatheinoxygenandexhalecarbondioxide.
Metoda přípravy
Průmyslová příprava
Metoda kalcinace
Plynný oxid uhličitý produkovaný procesem vysokoteplotní kalcinace vápence (ordolomitu) se promyje, zbaví nečistot a stlačí za vzniku plynného oxidu uhličitého:
.
Metoda regenerace plynu fermentace
Oplachování vodou, odstraňování nečistot, komprese, získávání oxidu uhličitého.
Metoda regenerace vedlejších produktů
Ammonia,hydrogen,andsyntheticammoniaareoftenproducedintheproductionprocessTheprocessofdecarburization(removalofcarbondioxideinthegasmixture)allowsthecarbondioxideinthemixedgastobeabsorbedunderpressureandheatedunderreducedpressuretoobtainhigh-puritycarbondioxidegas.
Metoda adsorpční expanze
Obvykle se jako surovinový plyn používá vedlejší produkt oxid uhličitý a používá se expanze adsorpce Metoda těží oxid uhličitý o vysoké čistotě z fáze adsorpce a shromažďuje produkt pomocí akryogenního čerpadla, lze jej použít připravovat napřípravě v metodě 3. porektifikace.Vysoce čisté produkty oxidu uhličitého.
CharcoalKilnMetoda
Rafinuje se z plynu získaného z uhlíkového pecního plynu az krakování metanolu Získejte oxid uhličitý.
Příprava v laboratoři
Příprava reakcí mramoru a zředěné kyseliny chlorovodíkové
Vzorec
Thelaboratoryproducescarbondioxide,marbleanddilutehydrochloricacid.Bothtypesofsodaarenotused,andthespeedistoofasttocontrol.
Withoutsulphuricacidhydrochloricacid,magnesiumsaltisnotascheapascalciumsalt.Nitricacidiseasytodecomposewhenexposedtolight.
Reakční produkty
Mramor nebo vápenec (hlavní složkou je CaCO₃) a zředěná kyselina chlorovodíková. (Laboratorní výroba oxidu uhličitého, mramoru a zředěné kyseliny chlorovodíkové)
Princip reakce
Reakční rovnice:
.Přípravné zařízení
Typ normální teploty pevná látka-kapalina (na obrázku).
Metoda sběru
Becausecarbondioxidehasahigherdensitythanair,itissolubleinwaterandcanreactwithwater,theupwardairexhaustmethodisadopted.
Metoda kontroly
Pourthegeneratedgasintoclarifiedlimewater.Thelimewaterbecomesturbid,whichprovesthatthegasiscarbondioxide.
Způsob úplné kontroly
Theburningwoodstickisusedatthemouthofthegascylinder(cannotbeinsertedintothebottle).Iftheflamegoesout,itisprovedSetfull.
Bezpečnostní opatření
①Plyn chlorovodík (HCl), který může při reakci těkat, může procházet nasyceným hydrogenuhličitanem sodným (NaHCO3) Roztok odstraňuje plynný chlorovodík ve vyvíjeném plynu.
②Ifnecessary,agasscrubberfilledwithconcentratedsulfuricacidcanbeusedtoremovewatervaporinthegeneratedgas.
③Cannotreactwithcalciumcarbonateandconcentratedhydrochloricacid.Reason:Concentratedhydrochloricacidiseasytovolatilizealargeamountofhydrogenchloridegas,sothatsodiumbicarbonatecannotbecompletelyremoved,andthepurityofthecarbondioxideproducedwilldecrease.
④V laboratoři reaguje mramor (CaCO3) se zředěnou kyselinou chlorovodíkovou za vzniku oxidu uhličitého.
⑤Nelze použít Na2CO3(soda)aNaHCO3(jedlá soda) místo CaCO3Reaguje s kyselinou chlorovodíkovou za vzniku oxidu uhličitého. Důvod :Na2CO3a NaHCO3reagují s kyselinou chlorovodíkovou velmi rychle,Produkovaný oxid uhličitý uniká rychle, což je snadné ovládat a snadno se ovládat.
⑥Namísto kyseliny chlorovodíkové nelze použít zředěnou kyselinu sírovou.Důvod:reakce zředěné kyseliny sírové s mramorem (CaCO3) bude generovat mikrosrážení síranu vápenatého (CaSO4)rozpuštěné ve vodním krytu, při výrobě síry a povrchu )
⑦Nelze použít MgCO3(hořečnatá sůl) místo CaCO3(vápenatá sůl),Důvod:Přestože MgCO3reaguje podobně s kyselinou chlorovodíkovou a CaCO3s kyselinou chlorovodíkovou, protože MgCO3má méně zdrojů, není to tak dobré jako CaCO3Levně dostupné. (Magnesiumsaltisnotascheapascalciumsalt)
⑧Kyselinu dusičnou nelze použít místo kyseliny chlorovodíkové.Důvod:kyselina dusičná se snadno rozloží, když je vystavena světlu().Pokud se místo kyseliny chlorovodíkové nepoužije kyselina dusičná, získá se COTam bude menší množství NO2a O2triclorica,exp. lze snadno rozložit, když je vystaven světlu)
⑨Becausecarbondioxidecanextinguishthefire,aburningmatchcanbeplacedatthemouthofthegascylinderforinspection.Iftheflamegoesout,itprovesthatthegascylinderhasbeenfilledwithcarbondioxide.(Identifythatmatchesarenotcombustible)
Tepelně rozložte hydrogenuhličitan sodný k přípravě
Po úplném vysušení hydrogenuhličitanu sodného se vloží do tvrdé skleněné trubice a ústí trubky se naplní skleněnou vatou a poté se zataví a vakuem se vytáhne vzduchovým čerpadlem. Potom se zahříváním rozloží hydrogenuhličitan sodný v hydrogenuhličitanem sodným. zavedené do trubek tvaru U obsahujících chlorid vápenatý a oxid fosforečný k jejich vysušení. Při 100 °C je rozkladný tlak hydrogenuhličitanu sodného 97,458 kPa a při 120 ° Citis 166,652 kPa.
Další způsoby přípravy
Při smíchání jedlé sody (hlavní složka je hydrogenuhličitan sodný) a bílého octa dochází k reakci ametatézy a uvolňuje se oxid uhličitý. Odpovídající rovnice chemické reakce je:
Mainapplications
High-puritycarbondioxideismainlyusedintheelectronicsindustry,medicalresearchandclinicaldiagnosis,carbondioxidelasers,calibrationgasfortestinginstrumentsandthepreparationofotherspecialmixedgas.Itisusedasaregulatorinthepolymerizationreaction.
Solidcarbondioxideiswidelyusedinrefrigerateddairyproducts,meat,frozenfoodandotherfoodsthatareperishableintransit.Itisusedasarefrigerantinmanyindustrialprocesses,suchascrushingheat-sensitivematerials,rubberpolishing,andmetalColdprocessing,shrinkassemblyofmechanicalparts,vacuumcoldtraps,etc.
Gaseouscarbondioxideisusedforcarbonizationofsoftdrinks,pHcontrolinwatertreatmentprocesses,chemicalprocessing,foodpreservation,inertprotectioninchemistryandfoodprocessing,weldinggas,plantgrowthstimulant,andhardeningincastingMoldsandcoresandusedinpneumaticdevices,andalsousedasadiluentforsterilizinggas(thatis,usingamixtureofethyleneoxideandcarbondioxideasasterilization,insecticide,andfumigant.Itiswidelyusedinmedicalappliances,packagingmaterials,andclothing,Fur,bedding,etc.,sterilizationofbonemeal,fumigationofwarehouses,factories,culturalrelics,books).
Liquidcarbondioxideisusedasarefrigerant,low-temperaturetestsofaircraft,missilesandelectroniccomponents,toimproveoilwellrecovery,rubberpolishingandchemicalreactioncontrol,andcanalsobeusedasafireextinguishingagent.
Superkritický oxid uhličitý lze použít jako rozpouštědlo k rozpouštění nepolárních, neiontových a nízkomolekulárních sloučenin, které se široce používají při homogenních reakcích.
Výpočet chemických dat
Výpočet referenční hodnoty hydrofobního parametru (XlogP) | 0,9 |
Počet akceptorů vodíkových vazeb | 2 |
Topologická molekulární polární povrchová plocha | 34.1 |
Počet těžkých atomů | 3 |
Složitost | 18.3 |
Počet jednotek kovalentních vazeb | 1 |
(Odkaz na tabulku:)
Bezpečnostní opatření
Aspekty přírodního prostředí
Nebezpečí pro životní prostředí
Přirozený skleníkový efekt: skleníkové plyny, jako je oxid uhličitý v atmosféře, mohou silně absorbovat dlouhovlnné záření ze země. Dlouhovlnné záření s delší vlnovou délkou je vyzařováno do země, což hraje roli při izolaci země.
Enhancedgreenhouseeffect:SincetheIndustrialRevolution,humanactivitieshaveemittedalargeamountofgreenhousegasessuchascarbondioxide,whichhascausedtheconcentrationofgreenhousegasesintheatmospheretorisesharply,resultinginanincreasinggreenhouseeffect.Accordingtostatistics,beforeindustrialization,theglobalaverageannualatmosphericcarbondioxideconcentrationwas278ppm(1ppmisonepartpermillion).In2012,theglobalaverageannualatmosphericcarbondioxideconcentrationwas393.1ppm.ByApril2014,themonthlyaveragecarbondioxideconcentrationintheatmosphereofthenorthernhemisphereItexceeded400ppmforthefirsttime.
Globalwarming:Theincreasinggreenhouseeffectoftheatmospherehasledtoglobalwarming,resultinginaseriesofglobalclimateproblemsthatareunpredictablebysciencetoday.AccordingtotheInternationalEconomicsofClimateChangeReport,ifhumanbeingscontinuetomaintaintheircurrentlifestyles,by2100,thereisa50%chancethattheglobalaveragetemperaturewillriseby4°C.Iftheglobaltemperaturerisesby4℃,theglaciersinthenorthandsouthpolesoftheearthwillmelt,andthesealevelwillriseasaresult.Morethan40islandcountriesandthemostpopulouscoastalcitiesintheworldwillbeindangerofbeingsubmerged,withtensofmillionsofpeopleworldwide.Hislifewillfaceacrisis,andevenaglobalecologicalbalancedisorderwilleventuallyleadtolarge-scalemigrationandconflictsaroundtheworld.
Protiopatření
Nízká životnost: Minimalizujte spotřebu energie pro každodenní život, čímž se sníží emise oxidu uhličitého, sníží se znečištění ovzduší a zpomalí se ekologická degradace.
CCStechnology:carbondioxidecaptureandstorage(CarbonDioxideCaptureandStorage,abbreviation:CCS)technology,isoneofthemostimportanttechnologiestodealwithglobalclimatechangeintheshortterm,referringtotheuseofcarboncapturetechnology,Separatethecarbondioxideproducedbyindustryandrelatedenergyindustries,andthentransportandsealittotheseabedorunderground,etc.,whichisisolatedfromtheatmosphere,throughstoragemeans.
Internationallaw:AttheUnitedNationsConferenceonEnvironmentandDevelopmentheldinBrazilinJune1992,153countriessignedtheUnitedNationsFrameworkConventiononClimateChange.ThisconventionhasbeeneffectivesinceMarch1994.Thereare176contractingparties(asofFebruary2015);InDecember1997,ameetingattendedbyparticipatingcountriesofthe"JointFrameworkConventiononClimateChange"washeldinKyoto,Japan.Themeetingformulatedthe"KyotoProtocol"asthe"JointFrameworkConventiononClimateChange".AsupplementaryclausetotheFrameworkConventiononChange.ThistreatyhasbeeneffectivesinceFebruary16,2005,andhas183contractingparties(asofFebruary2009);November30-December11,2015,heldinParisAtthe21stConferenceofthePartiestothe"JointFrameworkConventiononClimateChange"andthe11thConferenceofthePartiestothe"KyotoProtocol",representativesfrom195countriesunanimouslyadoptedthe"ParisAgreementoftheUnitedNationsFrameworkConventiononClimateChange"("ParisAgreement").
Intermsofhumanhealth
Researchshowsthatwhentheconcentrationofcarbondioxideintheairislessthan2%,thereisnoobviousharmtohumans.Iftheconcentrationexceedsthisconcentration,itcancausedamagetothehumanrespiratoryorgans.Undercircumstances,carbondioxideisnotatoxicsubstance,butwhentheconcentrationofcarbondioxideintheairexceedsacertainlimit,thebodywillbepoisoned,andhighconcentrationsofcarbondioxidewillsuffocatepeople.Animalexperimentshaveprovedthat:intheairwithnormaloxygencontent(20%),thehighertheconcentrationofcarbondioxide,thehigherthemortalityofanimals.Atthesametime,purecarbondioxidecausesanimaldeathsanddeathscausedbyloweroxygenaremorerapid.Inaddition,somepeoplebelievethatinthecaseoflowoxygen,carbondioxideataconcentrationof8%to10%cancausedeathsofhumansandanimalsinashortperiodoftime.
Princip otravy
High-concentrationcarbondioxideitselfhasstimulatingandanestheticeffectsandcancausehypoxiaandasphyxiationinthebody.
Příznaky otravy
Mírné:Obecné nepohodlí, jako jsou závratě, bolesti hlavy, svalová slabost a bolesti těla.
Střední:závratě mohou padat na zem;stah na hrudi,nesnesitelná bolest v nosní dutině a krku,dušnost,tlak a dušení na hrudi;silné bolesti hlavy,tinnitus,svalová slabost,zrzavá kůže,Krevní tlak se zvyšuje,pulz je dobrý.
Těžké:Náhle závrať a neschopnost udržet,pád na zem,zadržený dech,dušnost,bušení srdce,bezvědomí,koma,pohmožděná kůže,rty a nehty,sníží krevní tlak,slabý puls na dosah a rozšířené zornice.Takže světelný reflex zmizí a celé tělo se zhroutí a ostatní se změknou,při jedné ztrátě hlavní po akutním období.
První opatření
①Quicklygetthepoisonedpersonoutofthehigh-concentrationcarbondioxideenvironment,gotothefreshair,loosenthepoisonedperson’scollar,artificialassistanceBreatheinordertobreatheinoxygenassoonaspossible,andtreatwithhyperbaricoxygenifnecessary.Rescuersshouldweareffectiverespiratoryprotectiveequipment.
②Injectrespiratorystimulants,andantibioticsforsecondaryinfections;intravenousinfusionofsodiumbicarbonateorsodiumlactateforreducedcarbondioxidebindingcapacity;largerdosesofsedativesforlimbspasm;long-termhighfeverandconvulsionsSedativedrugscanbeused;othersymptomatictreatmentssuchaspulmonaryedemaandcerebraledema.
Bezpečnostní opatření
Beforeenteringaworkareawithahigherconcentrationofcarbondioxide,checkwhethertheconcentrationofcarbondioxideintheairexceeds2%.Ifitexceeds,youneedtoTakeeffectivesafetymeasures,suchas:①Ventilationanddetoxification,replacingtheairintheworkplace,sothattheconcentrationofcarbondioxideintheairdoesnotexceed2%;②Wearingventilationmasks,self-primingductgasmasks,oxygenbreathingapparatusandothercommonlyusedanti-virusmask.
Storageprecautions
Carbondioxideissuitableforstorageinacool,ventilatednon-combustiblegaswarehouse,suitableforshipmentinliquidorsolidform.Payattentiontothefollowingpointswhenstoringandtransportingcarbondioxide:①Keepawayfromfireandheatsources,andthestoragetemperatureshouldnotexceed30℃;②Storeseparatelyfromeasily(combustible)materialsandavoidmixedstorage;③Thestorageareashouldbeequippedwithleakageemergencytreatmentequipment.
Příslušné zákonyapředpisy
V Číně je oxid uhličitý uvolňován 12. dubna 2007 a implementován 1. listopadu 2007. Část 1: Limity expozice při práci pro nebezpečné faktory na pracovišti: 2. chem. věk (PC-TWA)na pracovišti je 9000 mg/m3,Přípustná koncentrace-krátkodobý limit expozice (PC-STEL)je18000mg/m3.Národní předpis úzce souvisí s oxidem uhličitým je národní normou"metodap pro stanovení oxidu uhličitéhov metodě 2xoxid uhličitývevzduchu20 při 4 pulsu 0 na 10.místě Místa.Tato norma byla schválena v září 2014. Nahrazena"PublicPlaceMetody hygienické kontrolyČást 2 :Chemické znečišťující látky"(GB/T18204.2-2014)vydané3.prosince 2014 a implementované 1.prosince 2014.Pro detekci oxidu uhelnatého,standardní metody detekce doporučené"PublicPlaceSanitationInspection:3chemickédetekce"minimální metoda 0,01 %) a metoda plynové chromatografie (nejnižší detekovatelná koncentrace je 0,014 %), metoda objemové titrace ( nejnižší detekovatelná koncentrace je 0,001 %).
Ve Spojených státech amerických je na Americké konferenci vládních průmyslových hygieniků (ACGIH) prahová koncentrace, v 0 pp 0 ppm pro bezpečnost a ochranu zdraví při práci (Správa pro bezpečnost a ochranu zdraví při práci, OSHA) je 0 0 ppm a 1 0 ppm institutu pro koncentraci NI a hodnoty doporučené × >-6).
