Въведение
In chemical kinetics, reaction rate constant , also known as rate constant k Or λ is a quantization representation of the chemical reaction rate.
For the Reactant A and Reactant B to be used as a chemical reaction of produce C , the reaction rate can be expressed This form:
k (t) е константата на скоростта на реакцията, която ще промени температурната промяна
[x] is assumed The volume of the substance X is in the case where the substance X is occurred in a fixed volume. (When the reaction occurs in a certain range, it can be expressed in the unit area of X.)
индекс m и n се означават като брой етапи на реакцията, в зависимост от механизма на реакцията. Може да се определи чрез опити.
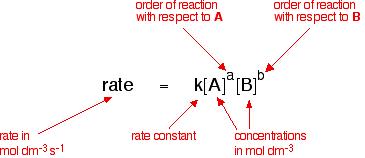
Ако реакцията може да бъде написана, тя може да бъде написана и като:
Уравнението на Arnicnis осигурява количествена основа за реагиране на връзката между скоростта на реакцията и енергията на активиране.
Скорост на химична реакция
The reaction rate is , the chemical reaction is slow, the unit is mol / (L · S) or MOL / (L · min) . The reduction in the concentration of the reactants in units of time or the amount of product concentration is increased. The concentration unit generally uses molar · sup> -1 , time units for seconds, minutes or hours. The chemical reaction is not uniformity: the reaction rate is divided into an average rate (average reaction rate at a time interval) and the instantaneous rate (the reaction rate given a given time) can be determined by experiment. The nature of the reactant itself, an external factor: temperature, concentration, pressure, catalyst, light, laser, reactant particle size, contact area and reactant state, X-ray, gamma ray, surface area of X-rays, gamma rays, solid substances, and The contact area of the reactants, the concentration of the reactants can also affect the chemical reaction rate.
сблъсък
теория на сблъсъка, е от германеца Макс Трауц и британеца Уилям Луис през 1916 и 1918 г. Изпратено отделно.
-
сблъсък: Възниква всяка химическа реакция, необходимите реакционни частици са близо до сблъсъка и скоростта на реакцията е пропорционална на броя на сблъсъците.
-
енергия на активиране: така наречената енергия на активиране е минималната енергия, която може да реагира на частиците.
-
Ефективен сблъсък: Така нареченият ефективен сблъсък означава, че енергията на сблъсъка надвишава енергията на активиране и посоката на сблъсък (битове) трябва да е правилна (енергията, необходима за химичните реакции).
Фактори, влияещи върху скоростта на реакцията
В допълнение към естеството на реагента, концентрацията, температурата и катализаторът също са важен фактор, влияещ върху скоростта на реакцията. Бързото забавяне на газовата реакция също е свързано с налягането. Увеличете концентрацията на реагента, т.е. броят на активираните молекули в единица обем се увеличава, като по този начин се увеличава броят на ефективните сблъсъци на молекулите на реагента в рамките на единица време, което води до ускоряване на скоростта на реакцията. Подобряването на реакционната температура, тоест процента на активиращите молекули, също увеличава броя на реагентните молекули в единици време, което води до ускоряване на скоростта на реакцията. С помощта на положителен катализатор реакционният процес е променен и енергията на активиране, необходима за реакция, и скоростта на реакцията се ускоряват. В химическото производство условията на реакцията често се контролират, за да се ускори скоростта на реакцията, за да се увеличи производството. Понякога е необходимо да се предприемат стъпки за забавяне на скоростта на реакцията, за да се удължи употребата на продуктите.
